Hlorisanje vode je proces dodavanje hlora(Cl2) ili hipohlorita u vodu. Ovim procesom se vrši dezinfekcija vode hlorom, odnosno ubijaju se bakterije i drugi mikroorganizmi. Hlorisanje vode se upotrebljava za prevenciju bolesti kao što su kolera, dizenterija, tifus itd.
U zavisnosti da li se dodaje gasni hlor ili hipohlorit, hlorisanje vode može biti:
 gasno hlorisanje vode
gasno hlorisanje vode
Sistem za gasno hlorisanje vode je projektovan tako da obezbedi da hlorna instalacia bude pod vakuumom, odnosno da što manji deo instalacije bude sa nadpritiskom. Sva instalacija koja je pod pritiskom, odnosno od boce za hlor do vakuum regulatora(obično do 6 bara), obavezno je da se smesti u posebnoj prostoriji(magacinu hlora), kako je to već definisano.
 tečno hlorisanje vode
tečno hlorisanje vode
Sistem za tečno hlorisanje vode najčešće se primenjuje kao sistemi za naknadno hlorisanje(dohlorisanje) i u slučajevima kada potrošnja vode koja se hloriše nije velika (npr. dezinfekcija vode u hotelima, školama, bazenima, manjim vodovodnim sistemima, mesarama, klanicama, mlekarama itd.).
Hlor
Hlor je jedan od najčešće korišćenih dezinfekcionih sredstava za dezinfekciju vode. On se može upotrebiti za deaktivaciju većine mikroorganizama i relativno je jeftin. Hlor je uvek u jedinjenju, zato što je veoma reaktivan element. Obično se nalazi zajedno sa natrijumom, kao što je kuhinjska so NaCl. Većina hlora se može naći rastvoreno u morima i slanim jezerima. Velike količine hlora se mogu naći u zemlji kao kamene soli.
Hlor je veoma reaktivan i korozivan gas. Kada se transportuje, skladišti ili koristi, bezbedonosne mere moraju biti preduzete. Vodeni hlor bi trebalo štititi od sunca, zato što se razgrađuje pod uticajem sunčeve svetlosti. Ultraljubičasta radijacija sunčeve svetlosti pomaže razgradnju molekula hipohloraste kiseline(HOCl). Prvo se molekul vode razgradi, uzrokujući da se elektroni oslobode što redukuje atom hlora hipohloraste kiseline do hlorida(Cl-). Tokom ove reakicje atom kiseonika je oslobođen, koji će biti konvertovan u molekul kiseonika.
Proizvodnja hlora
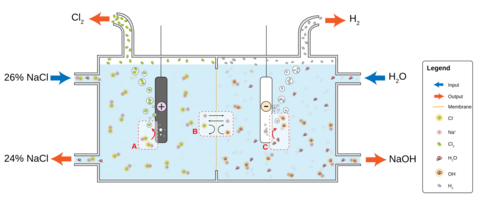
Hlor se proizvodi od hlorne veze elektrolitičkom ili hemijskom oksidacijom. Ovo se često postiže elektrolizom morske vode ili kamenih soli. Soli se rastvaraju u vodi, koja može provoditi veliku struju u elektrolitičkoj ćeliji. Zbog ove struje joni hlora(koji potiču od rastvaranje soli u vodi) se pretvaraju u atome hlora. So i voda su podeljeni u natrijum hidroksid i gas vodonika na katodi i gas hlora na anodi. Ovi produkti na katodi i anodi bi trebalo biti razdvojeni, zato što gas vodonika sa gasom hlora reaguje veoma agresivno.
Hlor se takođe može proizvesti oksidacijom vodonik hlorida sa kiseonikom iz vazduha. Bakar hlorid(CuCl2) se upotrebljava kao katalizator.Hlor se može dobiti elektrolizom rastopljene soli i oksidacijom hlorovodonične kiseline i mangan dioksida.
Dezinfekcija vode hlorom – hlorisanje vode
Hlor je jedan od najviše upotrebljavanih dezinfikacionih sredstava. Veoma je primenljiv i efektivan za deaktivaciju patogenih mikroorganizama. Hlor se može lako upotrebiti, izmeriti i kontrolisati. Prilično je postojan i relativno jeftin. On se upotrebljava u aplikacijama kao što su deaktivacija patogena u pijaćoj vodi, bazenima i otpadnim vodama.
Hlor ubija patogene kao što su bakterije i virusi razbijajući hemijske veze u njihovim molekulima. Dezinfekciona sredstva koja se upotrebljavaju za ovu namenu sastoje se od jedinjenja hlora koja mogu da razmenjuju atome sa drugim jedinjenjima kao što su enzimi u bakterijama i drugim ćelijama. Kada enzimi dođu u kontakt sa hlorom, jedan ili više atoma vodonika u molekulu bivaju zamenjeni sa hlorom. Ovo uzrokuje da ceo molekul menja oblik ili se raspadne. Kada enzimi ne funkcionišu kako treba, ćelija ili bakterija će umreti.
Kada se hlor doda u vodu, stvara se hipohlorasta kiselina:
Cl2 + H20 -> HOCl + H+ + Cl–
U zavisnosti od pH vrednosti, hipohlorasta kiselina se delom prelazi u hipohloritne jone:
Cl2 + 2H2O -> HOCl + H3O + Cl–
HOCl + H2O -> H3O+ + OCl–
Dalje se raspada na atome hlora i kiseonika:
OCl– -> Cl– + O
Hipohlorasta kiselina HOCl i joni hipohlorita OCl- su dobra dezinfikaciona sredstva. Ona je reaktivnija i jače dezinfikaciono sredstvo nego hipohlorit. Hipohlorasta kiselina se razdvaja na hlorovodoničnu kiselinu HCl i atom kiseonika O. Atom kiseonika je jako dezinfikaciono sredstvo. Dakle, dezinfikaciono dejstvo hlora u vodi je bazirano na oksidacionoj snazi slobodnog atoma kiseonika i na reakcijama supstitucije hlora, kada atomi vodonika bivaju zamenjeni sa hlorom.
Osobine dezinfekcije hlorom
Ćelijski zid patogenih mikroorganizama je po pririodi negativno naelektrisan, tako da može da bude probijen neutralnom hipohlorastom kiselinom radije nego negativno naelektrisanim jonom hipohlorita. Hipohlorasta kiselina može probiti spoljni sloj, ćelijski zid i zaštitne slojeve mikroorganizama i tako efektivno ubiti patogene. Mikroorganizmi bi ili uginuli ili bile onemogućene za reprodukciju.
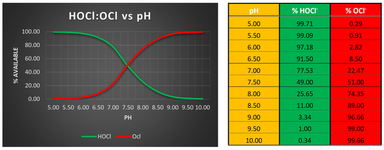
Efektivnost dezinfekcije je određeno pH vrednošću vode. Hlorisanje vode je optimalno kada je pH između 5,5 i 7,5. Hipohlorasta kiselina reaguje brže od jona hipohlorita, 80-100 % je efektivnija. Nivo hipohloraste kiseline će se smanjiti kada pH vrednost je veća. Na 7 pH vrednošću nivo hipohloraste kiseline je 75%, dok je koncentracija jona hipohlorita 25%. Kada je pH vrednost 8, odnos je obrnut. Pri 7,5 vrednošću pH, koncentracije hipohloriste kiseline i jona hipohlorita su iste.
Kada se hlor doda u vodu, on počinje da reaguje sa organskim i neorganskim jedinjenjima u vodi. Taj hlor ne može biti upotrebljen za dezinfekciju posle toga, zato što je formirao druge produkte. Hlor potreban za taj proces se naziva potreba vode za hlorom ili hlorni broj vode.
Hlor može reagovati sa amonijakom NH3 praveći hloramine, hemijska jedinjenja koja sadrže hlor, azot i vodonik. Ova jedinjenja se nazivaju aktivna jedinjenja hlora i takođe su dezinfikaciona sredstva ali mnogo lošija od hipohloraste kiseline i hipohlorita koji čine takozvani slobodni aktivni hlor.
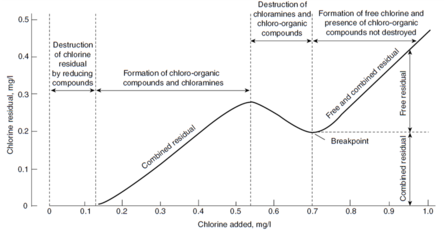
Hlorisanje vode preko prevojne tačke
Hlorisanje vode preko prevojne tačke se sastoji od kontinualnog dodavanja hlora u vodu do tačke kada se potreba vode za hlorom i sav amonijak je oksidovan, tako da samo ostaje samo slobodni hlor. Ovo se obično koristi za dezinfekciju, ali može se koristiti i za kontrolu mirisa i ukusa. Da bi došao do prevojne tačke, hiperhlorisanje se primenjuje odnosno dodaje se velika količina hlora.
Uticaj hlora na zdravlje
Reakcija ljudskog tela na hlor zavisi od koncentracije hlora u vazduhu, trajanja i frekvencije izlaganja. Efekati takođe zavise od zdravlja pojedinca i uslova životne sredine.
Udisanje male količine hlora tokom kratkog perioda može uticati na respiratorni sistem, kašljanje, bol u grudima i akumulacija tečnosti u plućima. Hlor takođe utiče na iritaciju kože i očiju. Čist hlor je veoma toksičan, čak i male količine mogu biti smrtonosne. Hlor je mnogo gušći od vazduha, uzrokujući formiranje toksičnog dima iznad tla.
Hlorisanje vode – propisi
Svetska zdravstvena organizacija je uvela standard koji kaže da 2-3 mg/l hlora treba dodati da bi dobio zadovoljavajuću dezinfekciju i koncentraciju reziduala. Maksimalni iznos hlora koji se može koristiti je 5 mg/l. Za efektivniju dezinfekciju količina rezidualnog hlora bi trebala biti iznad 0.5 mg/l posle 30 minuta vremena kontakta pri pH vrednosti 8 ili manje.